 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
|
Свойства альдегидов. Получение и применение
Урок поможет вам получить представление о теме«Химические свойства альдегидов и кетонов». Благодаря особым химическим свойствам альдегидов и кетонов, химики очень широко применяют эти вещества в органическом синтезе. На этом уроке вы сможете подробнее изучить эти свойства и их проявление в химических реакциях этих веществ.
I. Получение альдегидов
1. В промышленности

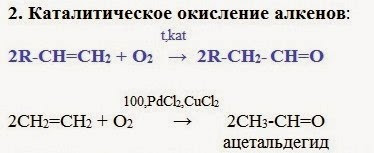

Этот способ более перспективен, чем гидратация алкинов, при которой используются токсичные ртутные катализаторы.

2. В лаборатории
1. Гидратация алкинов (раньше использовали в промышленности – способ дорогой) - присоединение:
Присоединение воды к ацетилену в присутствии солей ртути (II) приводит к образованию ацетальдегида:
Кетоны получают при гидратации других гомологов ряда алкинов:
2. Окисление спиртов
Для карбонильных соединений характерны реакции различных типов:
- присоединение по карбонильной группе;
- полимеризация;
- конденсация;
- восстановление и окисление.
Большинство реакций альдегидов и кетонов протекает по механизму нуклеофильного присоединения (AN) по связи С=О.

Атомы углерода и кислорода карбонильной группы связаны двойной связью. Из этого следует, что для этих веществ характерны реакции присоединения.
На атоме углерода карбонильной группы имеется частичный положительный заряд, значит, характерны нуклеофильные реакции.
Типичные реакции альдегидов и кетонов – нуклеофильное присоединение.
Нуклеофильные реакции – реакции, заключающиеся в атаке реагента, имеющего избыточную электронную плотность, на атом углерода с частичным положительным зарядом.
Нуклеофил (Nu) – частица с избытком электронной плотности.
Нуклеофилами могут быть: частицы с отрицательным зарядом (анионы F-, Cl-, Br-, I-, OH-, CH3O-, HS-, NH2-, CH3COO-); молекулы, содержащие атомы N, O, S, P c неподеленной электронной парой (H2O, NH3, H2S, PH3, CH3OH); молекулы, содержащие кратные связи углерод-углерод (H2C=CH2, HC≡CH, бензол C6H6).
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Это объясняется, главным образом, двумя факторами:
- углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп;
- углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на карбонильном атоме углерода, что затрудняет присоединение нуклеофильного реагента.
I.Реакции присоединения
1. Присоединение водорода (восстановление):
R-CH=O + H2t,Ni → R-CH2-OH (первичный спирт)
2. Присоединение циановодородной кислоты (синильной)
CH3-CH=O + H-CN → CH3-CH(CN)-OH
CH3-CH(CN)-OH циангидрин –яд! в ядрах косточек вишен, слив
3. Со спиртами– получают полуацетали и ацетали:
Полуацетали - соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR' и образованию ацеталя:
Ацетали - соединения, в которых атом углерода связан с двумя алкоксильными
(-OR) группами.
4. Присоединение воды
5. Присоединениереактива Гриньяра (используется для получения первичных спиртов, кроме метанола):
R-X(р-р в диэтиловом эфире) + Mg стружка → R-Mg-X (реактив Гриньяра) + Q
Здесь R – алкильный или арильный радикал; Х – это галоген.
HCH=O + CH3-Mg-Cl → CH3-CH2-O-Mg-Cl (присоединение)
CH3-CH2-O-Mg-Cl + H2O → CH3-CH2-OH + Mg(OH)Cl (гидролиз)
Присоединение R-MgHal к формальдегиду приводит к образованию первичных спиртов:
Из альдегидов получаются вторичные спирты:
В реакции с кетонами образуются третичные спирты:
6.Взаимодействие с аммиаком
Oбразуются имины:
II. Реакции окисления
1. Реакция серебряного зеркала – качественная реакция на альдегидную группу:
Видео-опыт: “Реакция "серебряного зеркала"
Видео-опыт: “Качественная реакция на альдегиды с фуксинсернистой кислотой”
При аккуратном нагревании альдегида в водно-аммиачном растворе оксида серебра стенки пробирки покрываются зеркальным слоем выделившегося серебра:
RCH=O + Ag2O → RCOOH + 2Ag↓.
Более правильно писать:
RCH=O + 2[Ag(NH3)2]OH → RCOONH4 + 2Ag↓ + 3NH3 + H2O
(cоль аммония)
Видео-опыт: “Качественная реакция на альдегиды с гидроксидом меди (II)”
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску томатного сока– образуется красный осадок оксида меди (I).
RCH=O + 2Cu(OH)2 → RCOOН + Cu2O↓ + 2H2O.
Более правильно писать:
RCH=O + 2Cu(OH)2 + NaOH → RCOONa + Cu2O↓ + 3H2O
 →
→
При нагревании формальдегида с гидроксидом меди выделяются пузырьки газа:
CH2=О + 4Cu(OH)2 → CO2↑ + 2Cu2O + 4H2O
III. Реакции замещения
Взаимодействие с галогенами:
CH3-CH=O + Cl2 → ClCH2-CH=O + HCl
здесь , ClCH2-CH=O - хлоруксусный альдегид
IV. Реакции полимеризации
Полимеризация - частный случай реакций присоединения - характерна в основном для альдегидов. Например, при стоянии 40% водного раствора формальдегида (формалина), в виде белого осадка образуется полимер формальдегида с невысокой молекулярной массой - параформ.
nCH2=O t,kat → (-CH2-O-)n полиформальдегид
V. Реакции поликонденсации
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем из двух или более относительно простых молекул образуется новая, более сложная молекула. Обычно в результате реакции конденсации выделяется молекула воды или другого вещества.
Конденсация, приводящая к образованию высокомолекулярных соединений, называется реакцией поликонденсации.
n H-CH=O + (n+1) C6H5-OH t,kat→ nH2O + [-C6H3(OH)-CH2-C6H3(OH)-]n
фенолформальдегидная смола
III. Применение
Метаналь (муравьиный альдегид) CH2=O
получение фенолформальдегидных смол;
получение мочевино-формальдегидных (карбамидных) смол;
полиоксиметиленовые полимеры;
синтез лекарственных средств (уротропин);
дезинфицирующее средство;
консервант биологических препаратов (благодаря способности свертывать белок).
Этаналь (уксусный альдегид, ацетальдегид) СН3СН=О
производство уксусной кислоты;
органический синтез.
IV. Тренажеры
Тренажер №1: “Получение альдегидов и кетонов”
Тренажер №2: “Химические свойства альдегидов”
Тестовые задания по теме "Альдегиды"
ЦОРы
Видео-опыт:“Реакция "серебряного зеркала"
Видео-опыт: “Качественная реакция на альдегиды с фуксинсернистой кислотой”
Видео-опыт: “Качественная реакция на альдегиды с гидроксидом меди (II)”



















