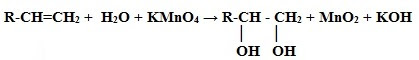Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом.
I. Гликоли (диолы)

|
Этиленгликоль (этандиол)
|
|
Формула
|
Модели молекулы
|
|
шаростержневая
|
полусферическая
|
|
HO-CH2CH2-OH
|

|
|
- Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49 ˚С) –это используется в системах охлаждения двигателей – антифризы.
- Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки.
II. Триолы
|
Глицерин (пропантриол-1,2,3)
|
|
Формула
|
Модели молекулы
|
|
шаростержневая
|
полусферическая
|
|
HOCH2-СH(OH)-CH2OH
|
|
|
- Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой.
- Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей.
Видео-опыт: “Изучение физических свойст глицерина”
III. Номенклатура
В названиях многоатомных спиртов (полиолов) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д. Например:

IV. Получение многоатомных спиртов
1. Получение двухатомных спиртов
В промышленности
1. Каталитическая гидратация оксида этилена (получение этиленгликоля):

2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей:

3. Из синтез-газа:
2CO + 3H2 250°,200МПа,kat → CH2(OH)-CH2(OH)
В лаборатории
1. Окисление алкенов:
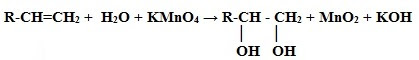
2. Получение трёхатомных спиртов (глицерина)
В промышленности
Омыление жиров (триглицеридов):

V. Химические свойства многоатомных спиртов
1. Кислотные свойства
1. С активными металлами:
HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия)
Видео-опыт: “Взаимодействие глицерина с металлическим натрием”
2. С гидроксидом меди(II) – качественная реакция!
Видео-опыт: “Взаимодействие многоатомных спиртов с гидроксидом меди (II)”

Упрощённая схема:

Видео-опыт: “Взаимодействие глицерина с перманганатом калия”
Видео-опыт: “Качественная реакция на многоатомные спирты”
2. Основные свойства
1. С галогенводородными кислотами
HO-CH2-CH2-OH + 2HCl H+↔ Cl-CH2-CH2-Cl + 2H2O
2. С азотной кислотой

Тринитроглицерин - основа динамита
VI. Применение
- Этиленгликоль производства лавсана, пластмасс, и для приготовленияантифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время); сырьё в органическом синтезе.
- Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Сорбит(шестиатомный спирт) используется как заменитель сахара для больных диабетом.Глицерин находит широкое применение в косметике, пищевой промышленности,фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
VII. Тренажеры
Тестовые задания по теме: "Спирты"
VIII. Дополнительно
А.Д. Вяземский. “Практическое пособие по химии”
ЦОРы
Видео-опыт:“Изучение физических свойст глицерина”
Видео-опыт:“Взаимодействие глицерина с металлическим натрием”
Видео-опыт:“Взаимодействие многоатомных спиртов с гидроксидом меди (II)”
Видео-опыт:“Взаимодействие глицерина с перманганатом калия”
Видео-опыт: “Качественная реакция на многоатомные спирты”
 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны