 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
|
Спирты: химические свойства, получение и применение
I. Химические свойства спиртов
В химических реакциях гидроксисоединений возможно разрушение одной из двух связей:
- С–ОН с отщеплением ОН-группы
- О–Н с отщеплением водорода
Это могут быть реакции замещения, в которых происходит замена ОН или Н, или реакция отщепления (элиминирования), когда образуется двойная связь.
Полярный характер связей С–О и О–Н способствует гетеролитическому их разрыву и протеканию реакций по ионному механизму. При разрыве связи О–Н с отщеплением протона (Н+) проявляются кислотные свойства гидроксисоединения, а при разрыве связи С–О – свойства основания и нуклеофильного реагента.

С разрывом связи О–Н идут реакции окисления, а по связи С–О – восстановления.
Таким образом, гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений. Вследствие доступности гидроксильных соединений, в особенности спиртов, каждая из этих реакций является одним из лучших способов получения определенных органических соединений.
1. Кислотно-основные свойства
RO- + H+ ↔ ROH ↔ R+ + OH-
алкоголят-ион
Кислотные свойства уменьшаются в ряду, а основные возрастают:
HOH → R-CH2-OH → R2CH-OH → R3C-OH
вода первичный вторичный третичный
1. Кислотные свойства
Взаимодействие с активными щелочными металлами:
Видео-опыт: “Взаимодействие этилового спирта с металлическим натрием”
2C2H5OH + 2 Na → 2C2H5ONa + H2
этилат натрия
Алкоголяты подвергаются гидролизу, это доказывает, что у воды более сильные кислотные свойства
C2H5ONa + H2O ↔ C2H5OH + NaOH
2. Основные свойства
Взаимодействие с галогенводородными кислотами:
Видео-опыт: “Взаимодействие этилового спирта с бромоводородом”
C2H5OH + HBr H2SO4(конц)↔ C2H5Br + H2O
бромэтан

Лёгкость протекания реакции зависит от природы галогенводорода и спирта – увеличение реакционной способности происходит в следующих рядах:
- HF < HCl < HBr < HI
- первичные < вторичные < третичные
2. Окисление
1). В присутствии окислителей [O] – K2Cr2O7 или KMnO4 спирты окисляются до карбонильных соединений:
Видео-опыт: “Окисление этилового спирта раствором перманганата калия”
Видео-опыт: “Окисление этилового спирта кристаллическим перманганатом калия”
Видео-опыт: “Каталитическое окисление этанола”
Видео-опыт: “Окисление этанола (тест на алкоголь)”
Первичные спирты при окислении образуют альдегиды, которые затем легко окисляются до карбоновых кислот.

При окислении вторичных спиртов образуются кетоны.

Третичные спирты более устойчивы к действию окислителей. Они окисляются только в жестких условиях (кислая среда, повышенная температура), что приводит к разрушению углеродного скелета молекулы и образованию смеси продуктов (карбоновых кислот и кетонов с меньшей молекулярной массой).
В кислой среде:
Для первичных и вторичных одноатомных спиртов качественной реакцией является взаимодействие их с кислым раствором дихромата калия. Оранжевая окраска гидратированного иона Cr2O72- исчезает и появляется зеленоватая окраска, характерная для иона Cr3+ . Эта смена окраски позволяет определять даже следовые количества спиртов.
CH3- OH + K2Cr2O7 + 4H2SO4 → CO2 + K2SO4 + Cr2(SO4)3 + 6H2O
3CH3-CH2-OH + K2Cr2O7 + 4H2SO4 → 3CH3COH + K2SO4 + Cr2(SO4)3 + 7H2O
В более жёстких условиях окисление первичных спиртов идёт сразу до карбоновых кислот: 3CH3-CH2-OH + 2K2Cr2O7 + 8H2SO4 t→ 3CH3COOH + 2K2SO4 + 2Cr2(SO4)3 + 11H2O
Третичные спирты устойчивы к окислению в щелочной и нейтральной среде. В жёстких условиях (при нагревании, в кислой среде) они окисляются с расщеплением связей С-С и образованием кетонов и карбоновых кислот.
В нейтральной среде:
CH3 – OH + 2KMnO4 →K2CO3 + 2MnO2 + 2H2O, а остальные спирты до солей соответствующих карбоновых кислот.
2). Качественная реакция на первичные спирты
Видео-опыт: “Горение спиртов”
3. Реакции отщепления
1) Внутримолекулярная дегидратация
CH3-CH2-CH(OH)-CH3 t>140,H2SO4(к)→ CH3-CH=CH-CH3 + H2O
бутанол-2 бутен-2

В тех случаях, когда возможны 2 направления реакции, например: 
Дегидратация идет преимущественно в направлении I, т.е. по правилу Зайцева – с образованием более замещенного алкена.
Правило Зайцева:
Водород отщепляется от наименее гидрированного атома углерода соседствующего с углеродом, несущим гидроксил.

2) Межмолекулярная дегидратация
2C2H5OH t<140,H2SO4(к)→ С2H5-O-C2H5 + H2O
простой эфир
При переходе от первичных спиртов к третичным увеличивается склонность к отщеплению воды и образованию алкенов; уменьшается способность образовывать простые эфиры.
3) Реакция дегидрирование и дегидратация предельных одноатомных спиртов –реакция С.В. Лебедева
2C2H5OH 425,ZnO,Al2O3→ CH2=CH-CH=CH2 + H2 + 2H2O
4. Реакции этерификации
Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима (обратный процесс – гидролиз сложных эфиров).
II. Получение спиртов
1. В промышленности
1. Из водяного газа (получение метанола – древесный спирт)
CO + 2H2 t,p → CH3OH
2. Брожение глюкозы (получение этанола)
C6H12O6 дрожжи → 2C2H5OH + 2CO2
3. Гидратация алкенов
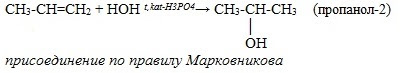
2. В лаборатории
Взаимодействие галогеналканов R-Г с водными растворами щелочей
CH3Cl + NaOH t, водн.р-р.→ CH3OH + NaCl (р. обмен)
III. Применение
Метанол СН3ОН – используют как растворитель, в производстве муравьиной кислоты, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол, в последнее время метанол рассматривают как перспективное моторное топливо. Большие объемы метанола используют при добыче и транспорте природного газа. Метанол – наиболее токсичное соединение среди всех спиртов, смертельная доза при приеме внутрь – 100 мл.
Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых кислот, используемых в качестве растворителей. Кроме того, этанол – основной компонент всех спиртных напитков, его широко применяют и в медицине как дезинфицирующее средство.
IV. Тренажеры
Тренажер №1: “Химические свойства предельных одноатомных спиртов”
Тренажер №2: “Способы получения предельных одноатомных спиртов”
Тестовые задания по теме "Спирты"
ЦОРы
Видео-эксперимент: “Окисление этилового спирта оксидом меди (II)”
Видео-опыт: “Качественная реакция на этанол”
Видео-опыт:“Качественная реакция на многоатомные спирты”
Видео-опыт: “Горение спиртов”
Видео-опыт:“Взаимодействие этилового спирта с металлическим натрием”
Видео-опыт: “Взаимодействие этилового спирта с бромоводородом”
Видео-опыт: “Окисление этилового спирта раствором перманганата калия”
Видео-опыт: “Окисление этилового спирта кристаллическим перманганатом калия”
Видео-опыт: “Каталитическое окисление этанола”
Видео-опыт: “Окисление этанола (тест на алкоголь)”




