 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
|
Бензол: физические и химические свойства, получение и применение
I. Физические свойства
Видео-опыт: “Изучение физических свойств бензола”
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Таблица. Физические свойства некоторых аренов
|
Название |
Формула |
t°.пл., |
t°.кип., |
|
Бензол |
C6H6 |
+5,5 |
80,1 |
|
Толуол (метилбензол) |
С6Н5СH3 |
-95,0 |
110,6 |
|
Этилбензол |
С6Н5С2H5 |
-95,0 |
136,2 |
|
Ксилол (диметилбензол) |
С6Н4(СH3)2 |
|
|
|
орто- |
|
-25,18 |
144,41 |
|
мета- |
|
-47,87 |
139,10 |
|
пара- |
|
13,26 |
138,35 |
|
Пропилбензол |
С6Н5(CH2)2CH3 |
-99,0 |
159,20 |
|
Кумол (изопропилбензол) |
C6H5CH(CH3)2 |
-96,0 |
152,39 |
|
Стирол (винилбензол) |
С6Н5CH=СН2 |
-30,6 |
145,2 |
Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
II. Получение аренов (бензола и его гомологов)
1. В лаборатории
1. Сплавление солей бензойной кислоты с твёрдыми щелочами
C6H5-COONa + NaOH t → C6H6 + Na2CO3
бензоат натрия
2. Реакция Вюрца-Фиттинга: (здесь Г – галоген)
С6H5-Г + 2Na + R-Г → C6H5-R + 2NaГ
С6H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
2. В промышленности
- выделяют из нефти и угля методом фракционной перегонки, риформингом;
- из каменноугольной смолы и коксового газа
1. Дегидроциклизацией алканов с числом атомов углерода больше 6:
C6H14 t, kat→ C6H6 + 4H2

2. Тримеризация ацетилена (только для бензола) – реакция Зелинского
3С2H2 600°C, акт. уголь → C6H6

3. Дегидрированием циклогексана и его гомологов
Советский академик Николай Дмитриевич Зелинский установил, что бензол образуется из циклогексана (дегидрирование циклоалканов)
C6H12 t, kat→ C6H6 + 3H2

C6H11-CH3 t, kat→ C6H5-CH3 + 3H2
метилциклогексан толуол
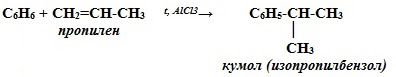
4. Алкилирование бензола (получение гомологов бензола) – реакция Фриделя-Крафтса
C6H6 + C2H5-Cl t, AlCl3→ C6H5-C2H5 + HCl
хлорэтан этилбензол
III. Химические свойства аренов
I. Реакции окисления
1. Горение (коптящее пламя):
Видео-опыт: “Горение бензола”
2C6H6 + 15O2 t → 12CO2 + 6H2O + Q
2. Бензол при обычных условиях не обесцвечивает бромную воду и водный раствор марганцовки
Видео-опыт: “Изучение отношения бензола к бромной воде и раствору перманганата калия”
3. Гомологи бензола окисляются перманганатом калия (обесцвечивают марганцовку):
а) в кислой среде до бензойной кислоты
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением a -атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:

5C6H5-C2H5 + 12KMnO4 + 18H2SO4 → 5C6H5COOH + 5CO2 + 6K2SO4 + 12MnSO4+28H2O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 +14H2O
Упрощённо:
C6H5-CH3 + 3O KMnO4 → C6H5COOH + H2O
б) в нейтральной и слабощелочной до солей бензойной кислоты
C6H5-CH3 + 2KMnO4 → C6H5COOК + KОН + 2MnO2 + H2O
II. Реакции присоединения (труднее, чем у алкенов)
1. Галогенирование
C6H6 +3Cl2 hν → C6H6Cl6 (гексахлорциклогексан - гексахлоран)

Видео-опыт: “Хлорирование бензола (получение гексахлорана)”
2. Гидрирование
C6H6 + 3H2 t,Pt или Ni → C6H12 (циклогексан)
3. Полимеризация
III. Реакции замещения – ионный механизм (легче, чем у алканов)
1. Галогенирование
a) бензола
C6H6 + Cl2 AlCl3→ C6H5-Cl + HCl (хлорбензол)

C6H6 + 6Cl2 t ,AlCl3→ C6Cl6 + 6HCl (гексахлорбензол)
C6H6 + Br2 t,FeCl3→ C6H5-Br + HBr (бромбензол)

Видео-опыт: “Бромирование бензола”
б) гомологов бензола при облучении или нагревании
По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ-облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (a -атома углерода).
1) C6H5-CH3 + Cl2 hν → C6H5-CH2-Cl + HCl
2) 
в) гомологов бензола в присутствии катализатора
C6H5-CH3 + Cl2 AlCl3→ (смесь орта, пара производных) + HCl
2. Нитрование (с азотной кислотой)
C6H6 + HO-NO2 t, H2SO4→ C6H5-NO2 + H2O
нитробензол - запах миндаля!

Видео-опыт: “Нитрование бензола”
C6H5-CH3 + 3HO-NO2 t, H2SO4→ СH3-C6H2(NO2)3 + 3H2O
2,4,6-тринитротолуол (тол, тротил)
IV. Применение бензола и его гомологов
Бензол C6H6 – хороший растворитель. Бензол в качестве добавки улучшает качество моторного топлива. Служит сырьем для получения многих ароматических органических соединений – нитробензола C6H5NO2 (растворитель, из него получают анилин), хлорбензола C6H5Cl, фенола C6H5OH, стирола и т.д.
Толуол C6H5–CH3 – растворитель, используется при производстве красителей, лекарственных и взрывчатых веществ (тротил (тол), или 2,4,6-тринитротолуол ТНТ).
Ксилолы C6H4(CH3)2. Технический ксилол – смесь трех изомеров (орто-, мета- и пара-ксилолов) – применяется в качестве растворителя и исходного продукта для синтеза многих органических соединений.
Изопропилбензол C6H5–CH(CH3)2 служит для получения фенола и ацетона.
Хлорпроизводные бензола используют для защиты растений. Так, продукт замещения в бензоле атомов Н атомами хлора – гексахлорбензол С6Сl6 – фунгицид; его применяют для сухого протравливания семян пшеницы и ржи против твердой головни. Продукт присоединения хлора к бензолу – гексахлорциклогексан (гексахлоран) С6Н6Сl6 – инсектицид; его используют для борьбы с вредными насекомыми. Упомянутые вещества относятся к пестицидам – химическим средствам борьбы с микроорганизмами, растениями и животными.
Стирол C6H5 – CH = CH2 очень легко полимеризуется, образуя полистирол, а сополимеризуясь с бутадиеном – бутадиенстирольные каучуки.
Применение бензола: полистирол
V. Тренажеры
Тренажер №1: “Способы получения гомологов бензола”
Тренажер №2: “Уравнения реакций, иллюстрирующие химические свойства бензола”
Тренажер №3: “Физические свойства бензола”
Тренажер №4: “Химические свойства гомологов бензола”
ЦОРы
Видео-опыт: “Изучение физических свойств бензола”
Видео-опыт: “Горение бензола”
Видео-опыт: “Изучение отношения бензола к бромной воде и раствору перманганата калия”
Видео-опыт: “Бромирование бензола”
Видео-опыт: “Нитрование бензола”
Видео-опыт: “Хлорирование бензола (получение гексахлорана)”

