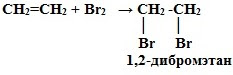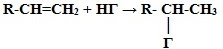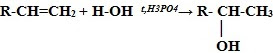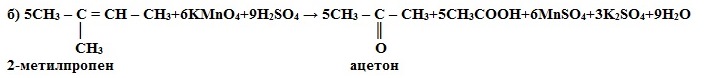Данный урок поможет вам получить представление о теме «Алкены. Химические свойства. Электрофильное присоединение». На этом занятии вы узнаете чем они отличаются от изученных ранее алканов и каковы особенности их реакций.
I. Физические свойства
Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) — газы, начиная с C5H10(амилен, или пентен-1) — жидкости, а с С18Н36 — твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо — в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Таблица 1. Физические свойства некоторых алкенов
|
Название
|
Формула
|
t пл,°С
|
t кип,°С
|
|
Этилен (этен)
|
С2Н4
|
-169,1
|
-103,7
|
|
Пропилен (пропен)
|
С3Н6
|
-187,6
|
-47,7
|
|
Бутилен (бутен-1)
|
C4H8
|
-185,3
|
-6,3
|
|
Цис-бутен-2
|
С4Н8
|
-138,9
|
3,7
|
|
Транс-бутен-2
|
С4Н8
|
-105,5
|
0,9
|
|
Изобутилен (2-метилпропен)
|
С4Н8
|
-140,4
|
-7,0
|
|
Амилен (пентен-1)
|
C5H10
|
-165,2
|
+30,1
|
|
Гексилен (гексен-1)
|
С6Н12
|
-139,8
|
63,5
|
|
Гептилен (гептен-1)
|
C7H14
|
-119
|
93,6
|
|
Октилен (октен-1)
|
C8H16
|
-101,7
|
121,3
|
|
Нонилен (нонен-1)
|
C9H18
|
-81,4
|
146,8
|
|
Децилен (децен-1)
|
С10Н20
|
-66,3
|
170,6
|
II. Химические свойства алкенов
Для алкенов наиболее типичными являются реакции присоединения. В реакциях присоединения двойная связь выступает как донор электронов, поэтому для алкенов характерны реакции электрофильного присоединения.
1. Реакции присоединения
1. Гидрирование (гидрогенизация – взаимодействие с водородом):
CnH2n + H2 t, Ni → CnH2n+2
2. Галогенирование (взаимодействие с галогенами):
CnH2n + Г2 → СnH2nГ2
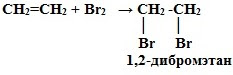
Это качественная реакция алкенов – бромная вода Br2 (бурая жидкость) обесцвечивается.
Опыт: “Взаимодействие этилена с бромной водой”
3. Гидрогалогенирование* (взаимодействие с галогенводородами):
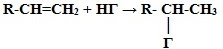
4. Гидратация* (присоединение молекул воды):
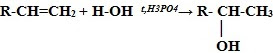
CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт)
* Присоединение галогенводородов и воды к несимметричным алкенам происходит поправилу Марковникова В.В.
Присоединение водорода происходит к наиболее гидрированному атому углерода при двойной углерод-углеродной связи.
Исключения!!!
1) Если в алкене присутствует электроноакцепторный заместитель, т.е. группа, способная оттягивать на себя электронную плотность:
F3C ← CH=CH2 + H-Br → F3C - CH2 - CH2(Br) 1,1,1- трифтор-3-бромпропан
2) Присоединение в присутствии Н2О2 (эффект Хараша) или органической перекиси (R-O-O-R ):
СH3-CH=CH2 + H-Br Н2О2 → H3C - CH2 - CH2(Br)
5. Реакции полимеризации:
nCH2=CH2 t, p, kat-TiCl4, Al(C2H5)3 → (-CH2-CH2-)n
мономер - этилен полимер – полиэтилен

2. Реакции окисления
1. Горение:
CnH2n + 3n/2O2 t, p, kat → nCO2 + nH2O + Q (пламя ярко светящее)
Опыт: “Горение этилена”
Частичное окисление этилена

2. Окисление перманганатом калия (р. Вагнера) в нейтральной среде – это качественная реакция алкенов, розовый раствор марганцовки обесцвечивается.

Влияние среды на характер продуктов реакций окисления
1) Окисление в кислой среде при нагревании идёт до а) карбоновых кислот; б) кетонов (если атом углерода при двойной связи содержит два заместителя); в) углекислого газа (если двойная связь на конце молекулы, то образуется муравьиная кислота, которая легко окисляется до CO2):
а) 5CH3-CH=CH-CH3 + 8KMnO4 + 12H2SO4 → 10CH3COOH + 8MnSO4 +4K2SO4 + 12H2O
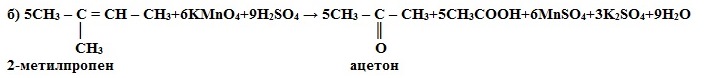
в) CH3 – CH2 – CH = CH2 + 2KMnO4 + 3H2SO4 → CH3CH2COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O
2) Окисление в нейтральной или слабощелочной среде на холоде (см. выше)
Опыт: “Взаимодействие этилена с раствором перманганата калия”
III. Тренажеры
Тренажер №1: “Уравнения реакций, характеризующие химические свойства этилена и пропилена”
Тренажер №2: “Химические свойства алкенов”
Тренажер №3: “Химические свойства алкенов (расчетные задачи)”
ЦОРы
Опыт: “Горение этилена”
Опыт:“Взаимодействие этилена с бромной водой”
Опыт: “Взаимодействие этилена с раствором перманганата калия”
 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны