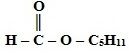Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Строение и свойства сложных эфиров, их применение
На данном уроке будет рассмотрена тема «Производные карбоновых кислот. Сложные эфиры». Благодаря этой теме, вы сможете познакомиться с производными карбоновых кислот. Также вы изучите самые важные функциональные производные карбоновых кислот – сложные эфиры. Рассмотрите их состав, некоторые свойства, формирование названий и сферы их применения в жизни.
I. Состав и строение сложных эфиров
Сложные эфиры – функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа (-ОН) замещена на остаток спирта (-OR).
Сложные эфиры карбоновых кислот – соединения с общей формулой R–COOR', где R и R' – углеводородные радикалы.

II. Физические свойства и нахождение сложных эфиров в природе
- Летучие, бесцветные жидкости
- Плохо растворимы в воде
- Чаще с приятным запахом
- Легче воды

Сложные эфиры содержатся в цветах, фруктах, ягодах.
Они определяют их специфический запах.
Являются составной частью эфирных масел (известно около 3000 эф.м. – апельсиновое, лавандовое, розовое и т. д.)
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
|
Аромат. Структурная формула. |
Название сложного эфира |
|
Яблоко  |
Этиловый эфир 2-метилбутановой кислоты
|
|
Вишня  |
Амиловый эфир муравьиной кислоты
|
|
Груша  |
Изоамиловый эфир уксусной кислоты
|
|
Ананас  |
Этиловый эфир масляной кислоты (этилбутират) |
|
Банан  |
Изобутиловый эфир уксусной кислоты (у изоамилацетата так же напоминает запах банана) |
|
Жасмин  |
Бензиловый эфир уксусной (бензилацетат)
|
Запахи эфиров:


Рис. 1.
Сложные эфиры нерастворимы в воде, но хорошо смешиваются со многими органическими веществами. Именно поэтому они используются как растворители для лаков и красок. Рис. 1. Этилацетат и метил ацетат – основа растворителя – жидкости для снятия лака с ногтей.
Температуры кипения сложных эфиров меньше, чем температуры кипения кислот и спиртов с близкой молярной массой. Почему? Сложные эфиры, в отличие от кислот и спиртов, не способны образовывать водородные связи между молекулами.

Сравнение температуры кипения эфиров
III. Номенклатура сложных эфиров
Краткие названия сложных эфиров строятся по названию радикала (R') в остатке спирта и названию группы RCOO- в остатке кислоты. Например, этиловый эфир уксусной кислоты CH3COOC2H5 называется этилацетат.
Названия по ИЮПАК выделены жирным шрифтом:
|
H–COO–C2H5 |
CH3–COO–CH3–CH3 |
CH2CH2–COO–C2H5 |
|
Этилформиат, этилметаноат; этиловый эфир муравьиной кислоты |
Метилацетат, метилэтаноат; метиловый эфир уксусной кислоты |
Этилбутират, этилбутаноат; этиловый эфир бутановой кислоты |

IV. Применение
- В качестве отдушек и усилителей запаха в пищевой и парфюмерной (изготовление мыла, духов, кремов) промышленности;
- В производстве пластмасс, резины в качестве пластификаторов.
Пластификаторы – вещества, которые вводят в состав полимерных материалов для придания (или повышения) эластичности и (или) пластичности при переработке и эксплуатации.

Применение в медицине
В конце XIX — начале ХХ века, когда органический синтез делал свои первые шаги, было синтезировано и испытано фармакологами множество сложных эфиров. Они стали основой таких лекарственных средств, как салол, валидол и др. Как местнораздражающее и обезболивающее средство широко использовался метилсалицилат, в настоящее время практически вытесненный более эффективными средствами.
V. Получение сложных эфиров
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
RCOOR' + H2O (H+)↔ RCOOH + R'OH
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
VI. Тренажеры
Тренажер №1: “Реакция этерификации”
ЦОРы
Видео-опыт: «Получение уксусноэтилового эфира»
Видео-опыт: «Получение борноэтилового эфира»