 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Свойства оксидов, кислот, оснований и солей в свете ТЭД и процессов окисления-восстановления
Как объяснить тот факт, что кислоты, соли и основания вступают в реакции не со всеми веществами, а со строго определенными? Чем определяются свойства кислот, оснований и солей?
На эти вопросы вы найдете ответы на данном уроке.
I. Химические свойства щелочей
1. Взаимодействие щелочей с кислотами: Me(OH)x + HxR
NaOH +HCl  NaCl + H2O
NaCl + H2O
Na+ + OH- + H+ + Cl-  Na++ Cl- + H2O
Na++ Cl- + H2O
H+ +OH-  H2O
H2O

2. Взаимодействие щелочей с кислотными оксидами: Me(OH)x + неMexOy
2NaOH +CO2 Na2CO3 + H2O
Na2CO3 + H2O
2Na+ + 2OH- + CO2 2Na+ + CO32- + H2O
2Na+ + CO32- + H2O
2OH- + CO2 CO32- + H2O
CO32- + H2O
Если через пробирку с известковой водой (Ca(OH)2) пропустить углекислый газ (CO2) , то известковая вода мутнеет, следствие образования соли – карбоната кальция (CaCO3).

3. Взаимодействие щелочей с солями: Me(OH)x + MexRy
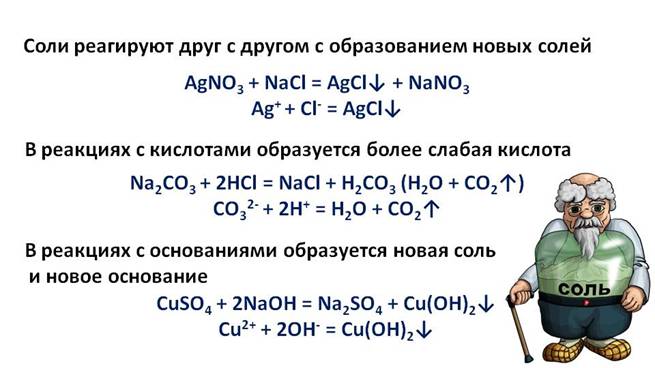
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но для этого нужно, чтобы образовался осадок или слабый электролит. Если в одну пробирку с гидроксида натрия добавить хлорида аммония (NH4Cl), во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III) (Fe2(SO4)3), а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2) и содержимое первой пробирки нагреем, то в результате появляется резкий запах аммиака (NH3). Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло.

2NaOH +MgCl2 Mg(OH)2
Mg(OH)2 + 2NaCl
+ 2NaCl
2Na++2OH-+ Mg2++2Cl-  Mg(OH)2
Mg(OH)2 +2Na++2Cl-
+2Na++2Cl-
2OH-+ Mg2+ Mg(OH)2
Mg(OH)2
II. Химические свойства солей
1. Взаимодействие солей с металлами: MexOy + Me*
Но нужно быть внимательным и обязательно пользоваться рядом активности металлов. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду.

При этом должны соблюдаться условия:
- обе соли (и реагирующая, и образующаяся) должны быть растворимыми
- металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
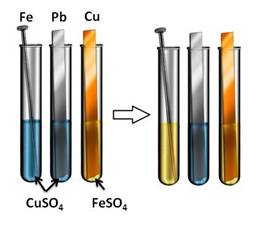
Посмотрим, как это происходит: в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II) (CuSO4), а в третью – раствор сульфата железа (II) (FeSO4). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe + CuSO4 = FeSO4 + Cu↓
Fe0 + Cu2+ = Fe2+ + Cu0↓
Pb + CuSO4 ≠
Cu + FeSO4 ≠
2. Взаимодействие солей с щелочами:
(см. выше)
3. Взаимодействие солей с кислотами:
(см. выше)
4. Взаимодействие солей с солями: MexRy + MexRy
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.
III. Химические свойства кислот
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H+), который всегда образуется при диссоциации.

Так, при диссоциации соляной кислоты (HCl), образуется ион водорода и хлорид-ион (Cl-), при диссоциации азотной кислоты (HNO3), тоже ион водорода и нитрат-ион (NO3-), при диссоциации азотистой кислоты (HNO2) – ион водорода и нитрит-ион (NO2-).
HCl = H+ + Cl-
HNO3 = H+ + NO3-
HNO2 ⇆ H+ + NO2-
Именно поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный цвет.
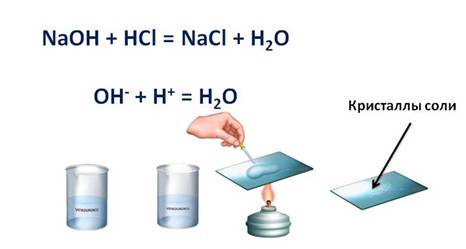
1. Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
2. Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
3. Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
- металл находиться в ряду напряжений до водорода
- должна получиться растворимая соль
- если кислота нерастворимая, то она не может вступить в реакцию с металлами.
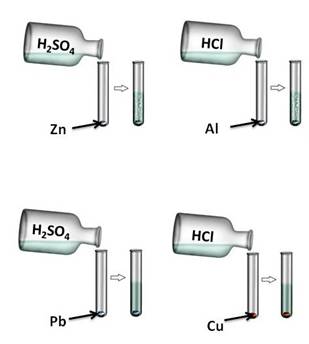
Давайте, попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую –алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты (H2SO4), во вторую и четвёртую – раствора соляной кислоты (HCl). Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
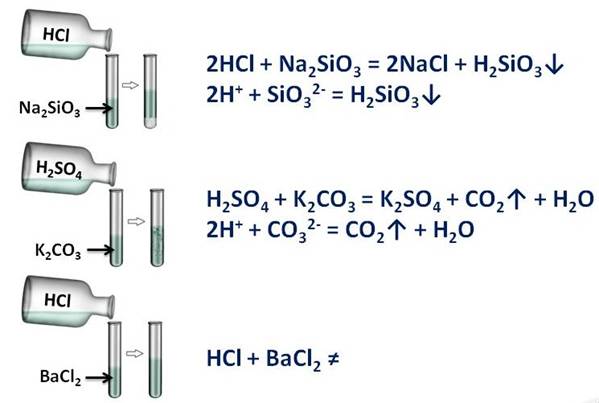
Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Соляна (HCl) и серная кислоты (H2SO4), вам покажут это: в первой пробирке будет соляная кислота и силикат натрия (Na2SiO3), во второй – серная кислота и карбоната калия (K2CO3), в третьей – опять соляной кислоты и хлорида бария (BaCl2). Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого осадка (H2SiO3), во второй – выделение газа (CO2), а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
IV. Выполнение упражнений
На “4” и “5”
Задание: составьте уравнения цепочки реакций (на “4”)
Еесли реакция является обменом, разберите ее как РИО, если реакция является ОВР, разберите ее с помощью электронного баланса (на “5”)
1) Fe(OH)3 → Fe2O3 → Fe → FeCl3 → FeOHCl2
2) Si → SiO2 → Na2SiO3 → H2SiO3 → SiO2
3) НCl → CaCl2 → Ca(OH)2 → CaCO3 → CO2
4) CO2 → CaCO3 → CaCl2 → CaCO3 → CO2
5) на “5”: Zn(OH)2 → Na2ZnO2 → ZnCl2 → ZnCO3 → ZnO
6) на “5”: Zn → Zn(НSO4)2 → ZnSO4 →Zn(OH)2 → Na2[Zn(OH)4]
7) на “5”: Al2O3 → KAlO2 → Al(OH)3 → Al2(SO4)3→ ВаSO4
8) Сu(OH)2 → CuO → Cu → CuSO4 → Cu(OH)2
9) P → P2O5 → H3PO4 → Ca3(PO4)2 → Ca(H2PO4)2
10) Fe → FeCl3 → FeOHCl2 → Fe2(SO4)3 → Fe(NO3)3
11) на “5”: AlCl3 → AlOHCl2 → Al(OH)3 → Na[Al(OH)4] → Na3[Al(OH)6]
12) Fe(OH)3 → FeOHSO4 → Fe2(SO4)3 → Fe(HSO4)2 → Fe(OH)3
13) на “5”: CrCl3 → Cr(OH)3 → Na3[Cr(OH)6] → CrCl3 →AgCl
14) CaCl2 → Ca(OH)2 → CaCO3 → CO2 → CaCO3
15) NaHCO3 → Na2CO3 → Na2O → Na2SO4 → NaOH
16) Cu → Cu(NO3)2 → Cu(OH)2 → CuCl2 → [Cu(NH3)4]Cl2 (последняя реакция на “5”)
17) CuSO4 → Cu → CuSO4→ Cu (OH)2 → CuO
18) на “5”: B → B2O3 → H3BO3 → HBO2 → KBO2
19) N2 → NH3 → NH4Cl → NH4OH → NH4NO3
20) Ва(OH)2 → ВаCO3 → ВаO → ВаCl2 → ВаSO4