 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Окислительно-восстановительные реакции
 Что нужно человеку для жизни? Воздух и еда. Мы поглощаем пищу и вдыхаем кислород и в нашем организме идут бесконечные процессы окисления, дающие нам энергию. Помните выражение: «Ты что, каши мало ел?»
Что нужно человеку для жизни? Воздух и еда. Мы поглощаем пищу и вдыхаем кислород и в нашем организме идут бесконечные процессы окисления, дающие нам энергию. Помните выражение: «Ты что, каши мало ел?»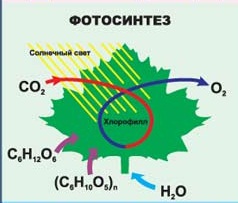 Как приятно летом прогуляться по лесу или парку. Вокруг так много зелени. Но откуда все это берется? Проведите опыт. Возьмите горшок с землей, взвесьте и посадите семечко. Через несколько лет оно превратится в большое растение. Взвесьте это растение и отдельно землю, в которой оно росло, и вы увидите, что масса земли не изменилась, в то время как масса растения увеличилась. Откуда она взялась? Не удивляйтесь. Это тоже благодаря окислительно – восстановительной реакции -фотосинтезу. В процессе фотосинтеза образуется так необходимый нам кислород и углеводы - строительный материал растений.
Как приятно летом прогуляться по лесу или парку. Вокруг так много зелени. Но откуда все это берется? Проведите опыт. Возьмите горшок с землей, взвесьте и посадите семечко. Через несколько лет оно превратится в большое растение. Взвесьте это растение и отдельно землю, в которой оно росло, и вы увидите, что масса земли не изменилась, в то время как масса растения увеличилась. Откуда она взялась? Не удивляйтесь. Это тоже благодаря окислительно – восстановительной реакции -фотосинтезу. В процессе фотосинтеза образуется так необходимый нам кислород и углеводы - строительный материал растений.

Если мы замерли, или хотим приготовить еду, то зажигаем огонь. Реакция горения это тоже окислительно – восстановительная реакция.
А знаете, что можно согреться и без огня, с помощью химических грелок. Например такой: совершенно сухую смесь железной (Fe) или алюминиевой (Al) стружки с солями меди (например, CuCl2) можно хранить довольно долго, а при добавлении воды температура сразу же повышается почти до 100оС за счет реакции:
Fe + CuCl2 = FeCl2 + Cu
При этом грелка, в которой хлорид меди CuCl2 превращается в хлорид железа FeCl2, сохраняет тепло около десяти часов.

I. Сущность окисления и восстановления
Если через раствор хлорида меди (II) пропускать электрический ток, то на катоде выделится медь, а на аноде образуется хлор.

Рис. 1. Электролиз раствора хлорида меди (II)
Изобразим схемы протекающих на электродах процессов:
НА КАТОДЕ: Cu2+ → Cu0
НА АНОДЕ: 2Cl- → Сl20
Чтобы катион меди Cu2+ превратился в электонейтральный атом меди, он должен принять от катода 2 электрона. Чтобы из двух анионов хлора Cl- образовалась молекула хлора, они должны отдать 2 электрона:
НА КАТОДЕ: Cu2+ + 2е → Cu0 (восстановление меди)
НА АНОДЕ: 2Cl- - 2е → Сl20 (окисление хлора)
Таким образом, можно сделать вывод:
Восстановление – процесс принятия электронов.
Окисление – процесс отдачи электронов.
Вещество, отдающее электроны, называется восстановителем. Вещество, принимающее электроны, называется окислителем.

Рис. 2. Переход электронов от восстановителя к окислителю
Окислитель, принимая электроны, сам при этом восстанавливается. Восстановитель, отдавая электроны, сам окисляется.
Процессы окисления и восстановления не могут протекать раздельно друг от друга, поэтому говорят об окислительно-восстановительной реакции.

Восстановителем может быть атом элемента, а восстановление - это процесс принятия электронов.

| O_кислитель | ВВ_осстановитель |
|---|---|
| ВВ_зял электроны | O_тдал электроны |
| ВВ_осстановился | O_кислился |
| S+6+2e¯→S+4 | S−2−2e¯→S0 |
| степень окисления ↓ | степень окисления ↑ |
| процесс восстановления | процесс окисления |
| Типичные окислители: | Типичные восстановители: |
|
|
Есть ряд мнемонических правил, которые позволяют лучше запомнить разницу между этими понятиями:
- По первым буквам слов можно составить следующие сокращения:
ОВВ: окислитель - взял e¯ - восстановился
ВОО: восстановитель - отдал - окислился
 2. Или использовать словосочетание "окислитель-грабитель".
2. Или использовать словосочетание "окислитель-грабитель". - 3. Запомнить стихотворение:
Восстановитель — это тот, кто электроны отдает.
Сам отдает грабителю, злодею-окислителю.
Отдает — окисляется, сам восстановителем является.
II. Электронный баланс
1. Посмотрите анимацию: “Метод электронного баланса”
В окислительно-восстановительной реакции число принятых электронов должно быть равно числу отданных электронов. В рассматриваемом процессе электронный баланс можно изобразить следующей схемой:
2е-
 |
Cu2+ + 2Cl- = Cu0 + Cl20
Если рассмотреть сущность еще одного окислительно-восстановительного процесса (между железом и сульфатом меди (II)), то мы увидим, что катионы меди в этой реакции выполняют роль окислителя. В результате происходит восстановление меди:
Fe + CuSO4 = FeSO4 + Cu
Cu2+ + 2e = Cu0
Роль восстановителя играет простое вещество железо:
Fe0 – 2e = Fe2+
При этом железо окисляется до двухзарядного катиона.
В этом методе сравнивают степени окисления атомов в исходных веществах и в продуктах реакции, при этом руководствуемся правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции.
Вы уже знаете, что окислительно-восстановительные реакции могут протекать под действием электрического тока. Такие реакции называют электролизом. Этот процесс был подробно изучен Майклом Фарадеем. Сегодня электролиз широко применяется в промышленности. С помощью него делают копии различных деталей, наносят на стальные детали автомобилей защитный слой другого металла.
III. Понятие «окислительно-восстановительные реакции»
Рассмотрим реакцию магния с кислородом. Запишем уравнение этой реакции и расставим значения степеней окисления атомов элементов:

Как видно, атомы магния и кислорода в составе исходных веществ и продуктов реакции имеют различные значения степеней окисления. Запишем схемы процессов окисления и восстановления, происходящих с атомами магния и кислорода.
До реакции атомы магния имели степень окисления, равную нулю, после реакции - +2. Таким образом, атом магния потерял 2 электрона:

Магний отдает электроны и сам при этом окисляется, значит, он является восстановителем.
До реакции степень окисления кислорода была равна нулю, а после реакции стала -2. Таким образом, атом кислорода присоединил к себе 2 электрона:

Кислород принимает электроны и сам при этом восстанавливается, значит, он является окислителем.
Запишем общую схему окисления и восстановления:

Число отданных электронов равно числу принятых. Электронный баланс соблюдается.
IV. Отличие окислительно-восстановительных реакций от других реакций
В окислительно-восстановительных реакциях происходят процессы окисления и восстановления, а значит, меняются степени окисления химических элементов. Это отличительный признак окислительно-восстановительных реакций.
Окислительно-восстановительными называют реакции, в которых химические элементы изменяют свою степень окисления.
Рассмотрим на конкретных примерах, как отличить окислительно-восстановительную реакцию от прочих реакций.
1. NaOH + HCl = NaCl + H2O
2. СН4 + 2О2 = СО2 + 2Н2О
Для того чтобы сказать, является ли реакция окислительно-восстановительной, необходимо расставить значения степеней окисления атомов химических элементов.
1. Na+1O-2H+1+ H+1Cl-1 = Na+1Cl-1 + H2+1O-2
Обратите внимание, степени окисления всех химических элементов слева и справа от знака равенства остались неизменными. Значит, эта реакция не является окислительно-восстановительной.
2. С-4Н4+1 + 2О20 = С+4О2-2 + 2Н2+1О-2
В результате данной реакции степени окисления углерода и кислорода поменялись. Причем углерод повысил свою степень окисления, а кислород понизил. Запишем схемы окисления и восстановления:
С-4 -8е =С+4 - процесс окисления
О20+4е = 2О-2 - процесс восстановления
Чтобы число отданных электронов было равно числу принятых, т.е. соблюдался электронный баланс, необходимо домножить вторую полуреакцию на коэффициент 2:
С-4 -8е =С+4 - восстановитель, окисляется
2О20 +8е = 4О-2 - окислитель, восстанавливается
Окислитель в ходе реакции принимает электроны, понижая свою степень окисления, он восстанавливается.
Восстановитель в ходе реакции отдает электроны, повышая свою степень окисления, он окисляется.
V. Алгоритм составления ОВР
|
Расставить коэффициенты в реакции, схема которой: HCl + MnO2 = Cl2 + MnCl2 + H2O |
|
Алгоритм расстановки коэффициентов |
|
1. Указываем степени окисления химических элементов. Подчёркнуты химические элементы, в которых изменились степени окисления. |
|
2. Составляем электронные уравнения, в которых указываем число отданных и принятых электронов. За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное (взято в красный кружок). Делим это число на число перемещённых электронов и получаем коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять коэффициент-1, который мы не пишем, и перед Cl2 тоже -1. |
|
Рассмотрим более сложное уравнение: |
|
H2S + KMnO4 + H2SO4 =S + MnSO4 + K2SO4 + H2O |
|
Расставляем степени окисления химических элементов: |
|
Электронные уравнения примут следующий вид Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции |
ЦОРы