 Персональный сайт учителя химии Кардаевой Татьяны Александровны
Персональный сайт учителя химии Кардаевой Татьяны Александровны
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Валентность химических элементов
Из материалов урока вы узнаете, что постоянство состава вещества объясняется наличием у атомов химических элементов определенных валентных возможностей; познакомитесь с понятием «валентность атомов химических элементов»; научитесь определять валентность элемента по формуле вещества, если известна валентность другого элемента; научитесь составлять химические формулы по валентности.
I. Понятие “валентность”
Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н2О. Возникает вопрос: почему вещества имеют постоянный состав?
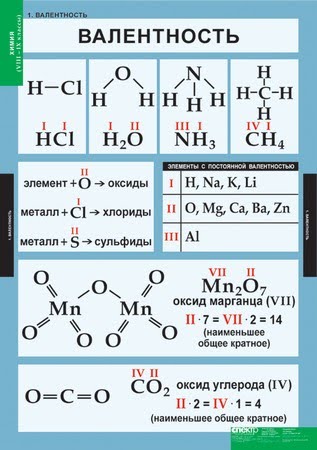
Проанализируем состав предложенных веществ: Н2О, NaH, NH3, CH4, HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Валентность – это способность атомов присоединять к себе определенное число других атомов.
Валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
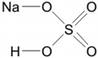
Na – одновалентен (одна связь)
H – одновалентен (одна связь)
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
II. Правила определения валентности элементов в соединениях
Посмотрите видео по данной теме:
- Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
- Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
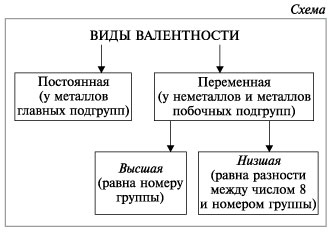
- Высшая валентность равна номеру группы.
- Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - N группы.
- У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
- У неметаллов в основном проявляются две валентности: высшая и низшая. Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
- Валентность может быть постоянной или переменной.
Валентность элементов необходимо знать, чтобы составлять химические формулы соединений.
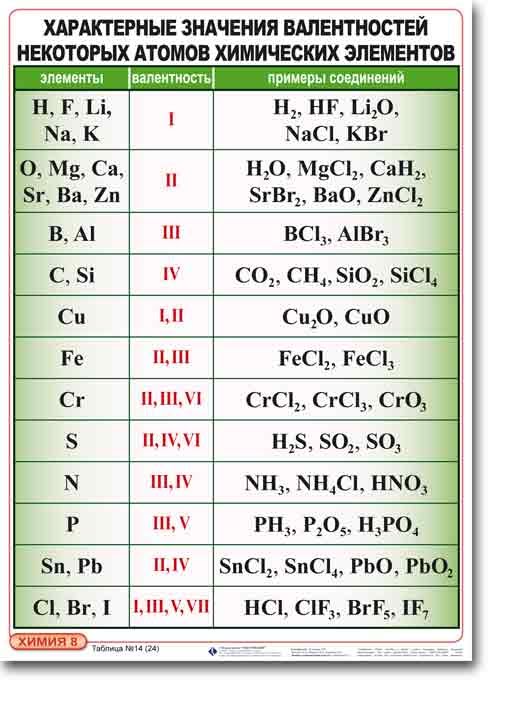
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН4.
Зная, что валентность водорода всегда равна I, а углерод присоединил к себе 4 атома водорода, можно утверждать, что валентность углерода равна IV. Валентность атомов обозначается римской цифрой над знаком элемента.
Пример 2. Определим валентность фосфорав соединении Р2О5.
Для этого необходимо выполнить следующие действия:
1. Над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. Умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. Разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
IV. Cоставление бинарных формулпо валентностям химических элементов
Бинарная химическая формула – это формула химического соединения, в состав которого входят два вида атомов.
V. Задания для закрепления
Задание №1.
Даны химические элементы и указана их валентность. Составьте соответствующие химические формулы:
I II V IV III VII III II IV III
Li O, Ba O, P O, SnO, P H, MnO, Fe O, H S, N O, Cr Cl
Задание №2.
Составьте формулы молекул для следующих соединений:
1) меди и кислорода,
2) цинка и хлора,
3) калия и йода,
4) магния и серы.
Задание №3.
Используя материалы лекции составьте бинарные формулы следующими элементами:
А) бор и кислород;
Б) алюминий и хлор;
В) литий и сера.
Задание №4
Определите валентность химических элементов по формулам их соединений:
NH3, FeCl3, Cr2O3, SO3, CH4, P2O5